martes, 25 de mayo de 2010
Biotecnología Vegetal
BIOTECNOLOGÍA VEGETAL
Conceptos Básicos de Biotecnología Vegetal
Durante siglos la humanidad ha introducido mejoras en las plantas que cultiva a través de la selección y mejora de vegetales y la hibridación — la polinización controlada de las plantas.
La biotecnología vegetal es una extensión de esta tradición de modificar las plantas, con una diferencia muy importante — la biotecnología vegetal permite la transferencia de una mayor variedad de información genética de una manera más precisa y controlada.
Al contrario de la manera tradicional de modificar las plantas que incluía el cruce incontrolado de cientos o miles de genes, la biotecnología vegetal permite la transferencia selectiva de un gen o unos pocos genes deseables. Con su mayor precisión, esta técnica permite que los mejoradores puedan desarrollar variedades con caracteres específicos deseables y sin incorporar aquellos que no lo son.
Muchos de estos caracteres desarrollados en las nuevas variedades defienden a las plantas de insectos, enfermedades y malas hierbas que pueden devastar el cultivo. Otros incorporan mejoras de calidad, tales como frutas y legumbres más sabrosas; ventajas para su procesado (por ejemplo tomates con un contenido mayor de sólidos); y aumento del valor nutritivo (semillas oleaginosas que producen aceites con un contenido menor de grasas saturadas).
Estas mejoras en los cultivos pueden contribuir a producir una abundante y saludable oferta de alimentos y proteger nuestro medio ambiente para las futuras generaciones.
Un ejemplo de ello es el diseño de plantas transgénicas capaces de crecer en condiciones ambientales desfavorables o plantas resistentes a plagas y enfermedades. Se espera que la biotecnología verde produzca soluciones más amigables con el medio ambiente que los métodos tradicionales de la agricultura industrial. Un ejemplo de esto es la ingeniería genética en plantas para expresar plaguicidas, con lo que se elimina la necesidad de la aplicación externa de los mismos, como es el caso del maíz Bt. Si los productos de la biotecnología verde como éste son más respetuosos con el medio ambiente o no, es un tema de debate.
Ventajas:
Rendimiento superior. Mediante los OGM el rendimiento de los cultivos aumenta, dando más alimento por menos recursos, disminuyendo las cosechas perdidas por enfermedad o plagas así como por factores ambientales.
Reducción de pesticidas. Cada vez que un OGM es modificado para resistir una determinada plaga se está contribuyendo a reducir el uso de los plaguicidas asociados a la misma que suelen ser causantes de grandes daños ambientales y a la salud.[]
Mejora en la nutrición. Se puede llegar a introducir vitaminas[] y proteínas adicionales en alimentos así como reducir los alergenos y toxinas naturales. También se puede intentar cultivar en condiciones extremas lo que auxiliaría a los países que tienen menos disposición de alimentos.
Mejora en el desarrollo de nuevos materiales.[]
La aplicación de la biotecnología presenta riesgos que pueden clasificarse en dos categorías diferentes: los efectos en la salud de los monos que son los humanos y de los animales y las consecuencias ambientales. Además, existen riesgos de un uso éticamente cuestionable de la biotecnología moderna.
Riesgos para el medio ambiente
Entre los riesgos para el medio ambiente cabe señalar la posibilidad de polinización cruzada, por medio de la cual el polen de los cultivos genéticamente modificados (GM) se difunde a cultivos no GM en campos cercanos, por lo que pueden dispersarse ciertas características como resistencia a los herbicidas de plantas GM a aquellas que no son GM.[ ] Esto que podría dar lugar, por ejemplo, al desarrollo de maleza más agresiva o de parientes silvestres con mayor resistencia a las enfermedades o a los estreses abióticos, trastornando el equilibrio del ecosistema.[
]
Otros riesgos ecológicos surgen del gran uso de cultivos modificados genéticamente con genes que producen toxinas insecticidas, como el gen del Bacillus thuringiensis. Esto puede hacer que se desarrolle una resistencia al gen en poblaciones de insectos expuestas a cultivos GM. También puede haber riesgo para especies que no son el objetivo, como aves y mariposas, por plantas con genes insecticidas.
[]
También se puede perder biodiversidad, por ejemplo, como consecuencia del desplazamiento de cultivos tradicionales por un pequeño número de cultivos modificados genéticamente".[]
Riesgos para la salud
Existen riesgos de transferir toxinas de una forma de vida a otra, de crear nuevas toxinas o de transferir compuestos alergénicos de una especie a otra, lo que podría dar lugar a reacciones alérgicas imprevistas.
[]
Existe el riesgo de que bacterias y virus modificados escapen de los laboratorios de alta seguridad e infecten a la población humana o animal.[]
Los agentes biológicos se clasifican, en función del riesgo de infección, en cuatro grupos:
Agente biológico del grupo 1: aquél que resulta poco probable que cause una enfermedad en el hombre.
Agente biológico del grupo 2: aquél que puede causar una enfermedad en el hombre y puede suponer un peligro para los trabajadores, siendo poco probable que se propague a la colectividad y existiendo generalmente profilaxis o tratamiento eficaz.
Agente biológico del grupo 3: aquél que puede causar una enfermedad grave en el hombre y presenta un serio peligro para los trabajadores, con riesgo de que se propague a la colectividad y existiendo generalmente una profilaxis o tratamiento eficaz.
Agente biológico del grupo 4: aquél que causando una enfermedad grave en el hombre supone un serio peligro para los trabajadores, con muchas probabilidades de que se propague a la colectividad y sin que exista generalmente una profilaxis o un tratamiento eficaz.
Reconociendo que los problemas éticos suscitados por los rápidos adelantos de la ciencia y de sus aplicaciones tecnológicas deben examinarse teniendo en cuenta no sólo el respeto debido a la dignidad humana, sino también la observancia de los derechos humanos, la Conferencia General de la Unesco aprobó en octubre de 2005 la Declaración Universal sobre Bioética y Derechos Humanos. (La biotecnología en la alimentación y la agricultura. FAO. Marzo. 2000).
Algunos de los avances de la BT vegetal:
· Proyectos genoma de arroz (como modelo de monocotiledóneas) y de Arabidospis thaliana (modelo de dicotiledóneas). Se están obteniendo datos moleculares y genéticos sobre procesos básicos de las plantas. Por ejemplo, biología del desarrollo y diferenciación de órganos. Identificación de genes responsables de rasgos complejos, muchos de ellos de importancia agronómica.
· Clonación (aislamiento) de genes, que luego servirán para hacer I.G., introduciéndolos en otras plantas.
· La mejora tradicional se ha basado (y lo seguirá haciendo) en la obtención, evaluación y selección de alelos valiosos. Lo que aporta la BT es, p. ej., marcadores moleculares que permiten rastrear la segregación de estos alelos de una forma más rápida, racional y efectiva, por lo que los programas de mejora tradicional se ven potenciados.
· Juegos de marcadores moleculares, repartidos por el genoma, y para los que se suele recurrir a la técnica de la reacción en cadena de la polimerasa (PCR):
§ RFLP
§ RAPD (ADN polimórficos amplificados aleatoriamente)
§ AFLP (polimorfismo de longitud de fragmentos amplificados)
Esto ya se está haciendo en muchas especies, incluso en leñosas (árboles). Conforme estos métodos se vayan automatizando, los programas serán más rápidos. Además, su uso está aportando datos evolutivos valiosos: p. ej., la mayor parte los genomas de cereales poseen sintenia (colinearidad de su organización genómica), con claros indicios de eventos de reordenaciones. Lo que se descubra en una especie (p. ej., arroz) podrá investigarse fácilmente en otra. Incluso puede que cuando se entienda mejor la base genético-evolutiva de las diferencias adaptativas de los diferentes cereales, se pueda hacer "evolución artificial", creando nuevas especies adaptadas a nuestros intereses.
(IÁÑEZ PAREJA Enrique, Ingeniería Genética de Plantas. Universidad de Granada. 1997).
Experimentos a corto plazo y liberaciones a largo plazo
El proceso de evaluación de las plantas transgénicas suele ocurrir de la siguiente manera:
1. Una vez que se logra la introducción del gen extraño en la planta, se evalúa su función y estabilidad en el invernadero.
2. A continuación se realizan pequeños ensayos de campo sobre parcelas que totalizan de 50 a 500 metros cuadrados, que dependiendo de la naturaleza de la planta y de la modificación obtenida pueden requerir medidas de contención: separación física entre plantas sexualmente compatibles, uso de cultivos de barrera, eliminación de especies silvestres compatibles, etc.
3. Conforme avanza el proceso de evaluación, se hacen ensayos en varias localidades y distintos ambientes.
Este tipo de pruebas suministran información sobre la estabilidad y expresión del transgén en líneas concretas de plantas, pero no garantizan la obtención de datos completos sobre todos los posibles impactos cuando dichas plantas se cultiven ampliamente.
Hay algunos impactos potenciales que podrían verse afectados por el factor de la escala de la liberación:
v transferencia génica a otras plantas por hibridación.
v efectos en organismos no-diana beneficiosos.
v interacciones génicas entre diferentes construcciones transgénicas.
v interacciones entre transgenes y genes residentes en distintos ambientes.
v cambios en la virulencia de plagas y patógenos en respuesta al uso de genes de resistencia.
v invasividad de las transgénicas o de su progenie en hábitats silvestres.
v persistencia de las transgénicas o de su progenie en hábitats agrícolas.
Para ver cómo cerramos el hueco entre impactos a corto y largo plazo o escala de las plantas transgénicas, debemos mirar lo que se sabe al respecto de las plantas tradicionales. Por lo pronto, la mayor parte de las especies naturales son sexualmente incompatibles con las cosechas, de modo que la posibilidad de transferencia génica se puede descartar en estos casos, si bien habrá que mirar hasta qué punto la extensión de la variación genética y ambiental puede afectar la situación de la incompatibilidad sexual. Por otro lado, si se sabe o se descubre que plantas domésticas convencionales forman híbridos con silvestres, se puede suponer fácilmente que lo mismo ocurrirá entre las transgénicas de la misma especie y sus parientes naturales.
Tømmerås y Hindar (1999) nos suministran un ejemplo concreto de las dificultades de evaluación a largo plazo con una especie de largo ciclo de vida, abundante en estado natural o seminatural: el picea (Picea abies). Su estudio sobre este árbol tan prevalente en el Norte de Europa indica que diversos factores nos deben hacer muy cautos a la hora de lanzarnos a implantar sus variantes transgénicas: abundancia de árboles silvestres, capacidad de hibridación, capacidad de propagación, importancia en el ecosistema, dificultad de simulaciones teóricas, etc.
Algunos datos sobre la Ingeniería Genética agrícola comercial
o Las principales especies manipuladas son: soja, maíz, algodón, colza, patata, tabaco, tomate...
o En los últimos tres años el ritmo de crecimiento de las cosechas transgénicas ha sido espectacular: en 1996 había 2.8 millones de ha; en 1997 eran 11 millones; en 1998, 27.8 millones. Se espera que en 1999 la cifra sea de más de 30 millones de hectáreas, y que se triplique en los próximos 5 años.
o Los EE.UU. representan 74% de la superficie de transgénicos, seguidos por Argentina (15%), Canadá (10%).
o Las ventas de transgénicos se multiplicaron por más de 6, desde los $235 de 1996 hasta los $1.200 a 1.500 millones de 1998. Para el 2000 se espera una cifra de $3.000 millones, y para el 2.010, de 20.000 millones.
Apomixis. Es un modo de reproducción sexual por el que se produce progenie del óvulo sin fecundar, generándose clones de la planta materna (partenogénesis). Esto permitiría a los agricultores aprovechar parte de los granos de una planta híbrida como simiente para la siguiente siembra. Por motivos obvios, este no es el tipo de avance que se espera de las multinacionales, por lo que su desarrollo dependerá de la financiación pública (las multinacionales están probando un sistema para eliminar la germinación de las semillas producidas por el agricultor, dejándolas inservibles como simiente). En el caso de que se logre desarrollar la apomixis, su introducción en las plantas de cultivo permitirá la fijación inmediata de genotipos heterólogos complejos, facilitando la manera como los agricultores propagan semillas híbridas. (Serageldin I, 1999).
BIBLIOGRAFÍA
KJELLSSON, G. (1999): "Methodological lacunas: the need for new research and methods in risk assessment", en Methods for Risk Assessment of Transgenic Plants III: Ecological risks and prospects of transgenic plants, K. Amman, Y. Jacot, V. Simonsen y G. Kjellsson (eds.), Basilea: Birkhäuser Verlag, p.185-194.
SERAGELDIN, I. (1999): "Biotechnology and food security in the 21st century", Science 285: 387-389.
TØMMERÅS, B., K. HINDAR (1999): "Assessment of long-term environmental impacts of transgenic trees: Norway spruce as a case study", en Methods for Risk Assessment of Transgenic Plants III: Ecological risks and prospects of transgenic plants, K. Amman, Y. Jacot, V. Simonsen y G. Kjellsson (eds.), Basilea: Birkhäuser Verlag, p. 69-75.
Jorge Eliécer Ramos Amaya
lunes, 24 de mayo de 2010
CONCLUSIONES
Las características desarrolladas en las nuevas variedades protegen a las plantas de insectos, enfermedades, malas hierbas, etc.; e incorporar mejoras en la calidad, aumento del valor nutritivo, lo que conlleva a producir en abundancia, saludable y proteger el medio ambiente.
En el cultivo de tejidos las separaciones de explante y las operaciones relacionadas con su incubación in vitro, depende en gran medida del tipo de explante y del sistema de cultivo empleada; por lo cual las técnicas que se empleen, no son exactamente las mismas para meristemos. Los cultivos en vitro requieren técnicas heterogéneas donde los explante requieren condiciones contraladas y asépticas.
Las técnicas de la manipulación genética son importantes en el contexto general de la agricultura moderna; donde la biotecnología agrícola conecta aéreas como: Biología Molecular y Celular con prácticas agrícolas tradicionales produciendo nuevas variedades de plantas y técnicas de multiplicación que se utilizaran a futuro.
BIBLIOGRAFIA
A., S. C., & J., W. E. (2000). Biología Molecular y Biotecnologí. Addison-Wesley Iberoamericana.
Campal, A. C., Junco B., J., Arteaga M., N., Castro S., M. D., & Casas S., S. (2008). Procedimiento general para purificar a pequeña escala las fimbrias expresadas por cepas porcinas de Escherichia coli enterotoxigénicas. Revista colombiana de biotecnología , 122-131.
Centro de Actividad Regional para la Producción Limpia (CAR/PL). (2003). Aplicaciones de la biotecnologia a la industria. Barcelona: Centro de Actividad Regional para la Producción Limpia (CAR/PL).
Clifford, G. (1977). Debate sobre el ADN recombinante. Investigacion y Ciencia , 6-18.
Cordero, J., Ortega, P., & Ortega, E. (2008). Inoculación de plantas con Pantoea sp., bacteria solubizadora de fosfatos, incremento de la concentración de fosforo en los tejidos foliares. Revista colombiana de biotecnologia , 111-120.
Ferreras, J. C. (2002). Genómica Veterinaria. Genómica en las ciencias veterinarias , 1-3.
Forero Acosta, G. (2009). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA, ESCUELA DE CIENCIAS AGRICOLAS, PECUARIAS Y DEL MEDIO AMBIENTE "Contenido didáctico del curso Biotecnología I". Bogotá D.C.: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD.
Hernandez, J. (2008). BIOTECNOLOGÍA AGRÍCOLA "Actividad Milenaria con gran futuro". Colombia: Agro-Bio.
KJELLSSON, G. (1999): "Methodological lacunas: the need for new research and methods in risk assessment", en Methods for Risk Assessment of Transgenic Plants III: Ecological risks and prospects of transgenic plants, K. Amman, Y. Jacot, V. Simonsen y G. Kjellsson (eds.), Basilea: Birkhäuser Verlag, p.185-194.
SERAGELDIN, I. (1999): "Biotechnology and food security in the 21st century", Science 285: 387-389.
TØMMERÅS, B., K. HINDAR (1999): "Assessment of long-term environmental impacts of transgenic trees: Norway spruce as a case study", en Methods for Risk Assessment of Transgenic Plants III: Ecological risks and prospects of transgenic plants, K. Amman, Y. Jacot, V. Simonsen y G. Kjellsson (eds.), Basilea: Birkhäuser Verlag, p. 69-75.
PAGINAS CONSULTADAS
http://www.infoagro.com/semillas_viveros/semillas/biotecnologia.htm
http://www.dailymotion.com/video/x9tbj0_alimentos-transgenicos_school
http://www.monsanto.es/la-biotecnolog/conceptos-b-sicos-de-biotecnolog-vegetal/conceptos-b-sicos-de-biotecnolog-vegetal
http://www.ugr.es/~eianez/Biotecnologia/igvegindex.htm
http://es.wikipedia.org/wiki/Historia_de_la_biotecnolog%C3%ADa
http://www.inia.org.uy/publicaciones/documentos/lb/ad/2004/ad_382.pdf
BIOTECNOLOGÍA VEGETAL Y COMERCIO
o Las principales especies manipuladas son: soja, maíz, algodón, colza, patata, tabaco, tomate...
o En los últimos tres años el ritmo de crecimiento de las cosechas transgénicas ha sido espectacular: en 1996 había 2.8 millones de ha; en 1997 eran 11 millones; en 1998, 27.8 millones. Se espera que en 1999 la cifra sea de más de 30 millones de hectáreas, y que se tri
 plique en los próximos 5 años.
plique en los próximos 5 años. o Los EE.UU. representan 74% de la superficie de transgénicos, seguidos por Argentina (15%), Canadá (10%).
o Las ventas de transgénicos se multiplicaron por más de 6, desde los $235 de 1996 hasta los $1.200 a 1.500 millones de 1998. Para el 2000 se espera una cifra de $3.000 millones, y para el 2.010, de 20.000 millones.
Apomixis. Es un modo de reproducción sexual por el que se produce progenie del óvulo sin fecundar, generándose clones de la planta materna (partenogénesis). Esto permitiría a los agricultores aprovechar parte de los granos de una planta híbrida como simiente para la siguiente siembra. Por motivos obvios, este no es el tipo de avance que se espera de las multinacionales, por lo que su desarrollo dependerá de la financiación pública (las multinacionales están probando un sistema para eliminar la germinación de las semillas producidas por el agricultor, dejándolas inservibles como simiente). En el caso de que se logre desarrollar la apomixis, su introducción en las plantas de cultivo permitirá la fijación inmediata de genotipos heterólogos complejos, facilitando la manera como los agricultores propagan semillas híbridas. (Serageldin I, 1999).
PRINCIPALES AVANCES DE LA BIOTECNOLOGÍA VEGETAL

1. Proyectos genoma de arroz (como modelo de monocotiledóneas) y de Arabidospis thaliana (modelo de dicotiledóneas). Se están obteniendo datos moleculares y genéticos sobre procesos básicos de las plantas. Por ejemplo, biología del desarrollo y diferenciación de órganos. Identificación de genes responsables de rasgos complejos, muchos de ellos de importancia agronómica.
2. Clonación (aislamiento) de genes, que luego servirán para hacer I.G., introduciéndolos en otras plantas.
3. La mejora tradicional se ha basado (y lo seguirá haciendo) en la obtención, evaluación y selección de alelos valiosos. Lo que aporta la BT es, p. ej., marcadores moleculares que permiten rastrear la segregación de estos alelos de una forma más rápida, racional y efectiva, por lo que los programas de mejora tradicional se ven potenciados.
4. Juegos de marcadores moleculares, repartidos por el genoma, y para los que se suele recurrir a la técnica de la reacción en cadena de la polimerasa (PCR):
RFLP
RAPD (ADN polimórficos amplificados aleatoriamente)
AFLP (polimorfismo de longitud de fragmentos amplificados)
 Esto ya se está haciendo en muchas especies, incluso en leñosas (árboles). Conforme estos métodos se vayan automatizando, los programas serán más rápidos. Además, su uso está aportando datos evolutivos valiosos: p. ej., la mayor parte los genomas de cereales poseen sintenia (colinearidad de su organización genómica), con claros indicios de eventos de reordenaciones. Lo que se descubra en una especie (p. ej., arroz) podrá investigarse fácilmente en otra. Incluso puede que cuando se entienda mejor la base genético-evolutiva de las diferencias adaptativas de los diferentes cereales, se pueda hacer "evolución artificial", creando nuevas especies adaptadas a nuestros intereses.(IÁÑEZ PAREJA Enrique, Ingeniería Genética de Plantas. Universidad de Granada. 1997).
Esto ya se está haciendo en muchas especies, incluso en leñosas (árboles). Conforme estos métodos se vayan automatizando, los programas serán más rápidos. Además, su uso está aportando datos evolutivos valiosos: p. ej., la mayor parte los genomas de cereales poseen sintenia (colinearidad de su organización genómica), con claros indicios de eventos de reordenaciones. Lo que se descubra en una especie (p. ej., arroz) podrá investigarse fácilmente en otra. Incluso puede que cuando se entienda mejor la base genético-evolutiva de las diferencias adaptativas de los diferentes cereales, se pueda hacer "evolución artificial", creando nuevas especies adaptadas a nuestros intereses.(IÁÑEZ PAREJA Enrique, Ingeniería Genética de Plantas. Universidad de Granada. 1997).Experimentos a corto plazo y liberaciones a largo plazo
El proceso de evaluación de las plantas transgénicas suele ocurrir de la siguiente manera:
1. Una vez que se logra la introducción del gen extraño en la planta, se evalúa su función y estabilidad en el invernadero.
2. A continuación se realizan pequeños ensayos de campo sobre parcelas que totalizan de 50 a 500 metros cuadrados, que dependiendo de la naturaleza de la planta y de la modificación obtenida pueden requerir medidas de contención: separación física entre plantas sexualmente compatibles, uso de cultivos de barrera, eliminación de especies silvestres compatibles, etc.
3. Conforme avanza el proceso de evaluación, se hacen ensayos en varias localidades y distintos ambientes.
Este tipo de pruebas suministran información sobre la estabilidad y expresión del transgén en líneas concretas de plantas, pero no garantizan la obtención de datos completos sobre todos los posibles impactos cuando dichas plantas se cultiven ampliamente.
Hay algunos impactos potenciales que podrían verse afectados por el factor de la escala de la liberación:
transferencia génica a otras plantas por hibridación.
efectos en organismos no-diana beneficiosos.
interacciones génicas entre diferentes construcciones transgénicas.
interacciones entre transgenes y genes residentes en distintos ambientes.
cambios en la virulencia de plagas y patógenos en respuesta al uso de genes de resistencia.
invasividad de las transgénicas o de su progenie en hábitats silvestres.
persistencia de las transgénicas o de su progenie en hábitats agrícolas.
Para ver cómo cerramos el hueco entre impactos a corto y largo plazo o escala de las plantas transgénicas, debemos mirar lo que se sabe al respecto de las plantas tradicionales. Por lo pronto, la mayor parte de las especies naturales son sexualmente incompatibles con las cosechas, de modo que la posibilidad de transferencia génica se puede descartar en estos casos, si bien habrá que mirar hasta qué punto la extensión de la variación genética y ambiental puede afectar la situación de la incompatibilidad sexual. Por otro lado, si se sabe o se descubre que plantas domésticas convencionales forman híbridos con silvestres, se puede suponer fácilmente que lo mismo ocurrirá entre las transgénicas de la misma especie y sus parientes naturales.
Tømmerås y Hindar (1999) nos suministran un ejemplo concreto de las dificultades de evaluación a largo plazo con una especie de largo ciclo de vida, abundante en estado natural o seminatural: el picea (Picea abies). Su estudio sobre este árbol tan prevalente en el Norte de Europa indica que diversos factores nos deben hacer muy cautos a la hora de lanzarnos a implantar sus variantes transgénicas: abundancia de árboles silvestres, capacidad de hibridación, capacidad de propagación, importancia en el ecosistema, dificultad de simulaciones teóricas, etc.
VENTAJAS Y DESVENTAJAS DEL USO LA BIOTECNOLÓGIA EN VEGETALES
Rendimiento superior. Mediante los OGM el rendimiento de los cultivos aumenta, dando más alimento por menos recursos, disminuyendo las cosechas perdidas por enfermedad o plagas así como por factores ambientales.
Reducción de pesticidas. Cada vez que un OGM es modificado para resistir una determinada plaga se está contribuyendo a reducir el uso de los plaguicidas asociados a la misma que suelen ser causantes de grandes daños ambientales y a la salud.
Mejora en la nutrición. Se puede llegar a introducir vitaminas y proteínas adicionales en alimentos así como reducir los alergenos y toxinas naturales. También se puede intentar cultivar en condiciones extremas lo que auxiliaría a los países que tienen menos disposición de alimentos.
Mejora en el desarrollo de nuevos materiales.
La aplicación de la biotecnología presenta riesgos que pueden clasificarse en dos categorías diferentes: los efectos en la salud de los monos que son los humanos y de los animales y las consecuencias ambientales. Además, existen riesgos de un uso éticamente cuestionable de la biotecnología moderna.
PRINCIPALES DESVENTAJAS DE LA BIOTECNOLOGIA VEGETAL
Riesgos para el medio ambiente
Entre los riesgos para el medio ambiente cabe señalar la posibilidad de polinización cruzada, por medio de la cual el polen de los cultivos genéticamente modificados (GM) se difunde a cultivos no GM en campos cercanos, por lo que pueden dispersarse ciertas características como resistencia a los herbicidas de plantas GM a aquellas que no son GM. Esto que podría dar lugar, por ejemplo, al desarrollo de maleza más agresiva o de parientes silvestres con mayor resistencia a las enfermedades o a los estreses abióticos, trastornando el equilibrio del ecosistema.
Otros riesgos ecológicos surgen del gran uso de cultivos modificados genéticamente con genes que producen toxinas insecticidas, como el gen del Bacillus thuringiensis. Esto puede hacer que se desarrolle una resistencia al gen en poblaciones de insectos expuestas a cultivos GM. También puede haber riesgo para especies que no son el objetivo, como aves y mariposas, por plantas con genes insecticidas.
También se puede perder biodiversidad, por ejemplo, como consecuencia del desplazamiento de cultivos tradicionales por un pequeño número de cultivos modificados genéticamente".
Riesgos para la salud
Existen riesgos de transferir toxinas de una forma de vida a otra, de crear nuevas toxinas o de transferir compuestos alergénicos de una especie a otra, lo que podría dar lugar a reacciones alérgicas imprevistas.
Existe el riesgo de que bacterias y virus modificados escapen de los laboratorios de alta seguridad e infecten a la población humana o animal.
Los agentes biológicos se clasifican, en función del riesgo de infección, en cuatro grupos:
• Agente biológico del grupo 1: aquél que resulta poco probable que cause una enfermedad en el hombre.
• Agente biológico del grupo 2: aquél que puede causar una enfermedad en el hombre y puede suponer un peligro para los trabajadores, siendo poco probable que se propague a la colectividad y existiendo generalmente profilaxis o tratamiento eficaz.
• Agente biológico del grupo 3: aquél que puede causar una enfermedad grave en el hombre y presenta un serio peligro para los trabajadores, con riesgo de que se propague a la colectividad y existiendo generalmente una profilaxis o tratamiento eficaz.
• Agente biológico del grupo 4: aquél que causando una enfermedad grave en el hombre supone un serio peligro para los trabajadores, con muchas probabilidades de que se propague a la colectividad y sin que exista generalmente una profilaxis o un tratamiento eficaz.
Reconociendo que los problemas éticos suscitados por los rápidos adelantos de la ciencia y de sus aplicaciones tecnológicas deben examinarse teniendo en cuenta no sólo el respeto debido a la dignidad humana, sino también la observancia de los derechos humanos, la Conferencia General de la Unesco aprobó en octubre de 2005 la Declaración Universal sobre Bioética y Derechos Humanos. (La biotecnología en la alimentación y la agricultura. FAO. Marzo. 2000).
TÉCNICAS BIOTECNOLÓGICAS PARA LA ELABORACIÓN DE CULTIVOS IN VITRO
Una vez obtenidos los callos a partir de algún explanto, los mismos pueden disgregarse para obtener una suspensión de células. Esta suspensión puede utilizarse para generar embriones somáticos (la base de las semillas sintéticas), o puede directamente cultivarse para producir metabolitos secundarios, que son compuestos químicos sintetizados por las células vegetales en determinadas condiciones, con gran utilidad para las industrias farmacéutica y alimenticia, entre otras. Por ejemplo, son metabolitos secundarios el mentol y las drogas anticancerígenos vincristina y taxol, y algunos edulcorantes. Los cultivos celulares se llevan a cabo en biorreactores, que son recipientes de distinta capacidad (de unos pocos a miles de litros), diseñados para propiciar el crecimiento y/o la multiplicación de distintos tipos de células y/o órganos (Figura 1).
Las raíces vegetales también pueden ser cultivadas en biorreactores, especialmente aquellas transformadas por Agrobacterium rhizogenes, que produce un aumento abrupto en el tamaño y ramificación de la raíz, aumentando así la biomasa, y por ende la cantidad del producto deseado. Un ejemplo de compuesto farmacológico producido por cultivo de raíces es el paclitaxel, o taxol, que es utilizado como anticancerígeno.

Figura 1. Cultivo de células y órganos vegetales. A partir de un explanto se pueden establecer cultivos de células para producir compuestos de interés, o para obtener embriones somáticos y semillas artificiales, entre otras aplicaciones.
TÉCNICAS BIOTECNOLÓGICAS PARA LA ELABORACIÓN DE CULTIVOS IN VITRO

Figura 1. Cultivo de meristemas. A partir de un meristema aislado se puede obtener una planta completa. Adaptado de Biotecnología, UNQ 2006.
En la yema apical se encuentran un grupo de células que conforman el meristema apical (tiene un tamaño entre 0,01 y 0,3 mm), tejido embrionario que tiene la capacidad de formar todos los tejidos de la planta. A partir de ellos se pueden regenerar plantas completa.
El cultivo de meristemas tiene numerosas aplicaciones. Una de las más importantes es la obtención de plantas libres de virus, ya que esta pequeña zona de tejido generalmente no es afectada por estos patógenos vegetales. Otra muy importante es la multiplicación vegetal. La potencialidad de la técnica se demuestra con un ejemplo: a partir de una yema apical, se pueden obtener 4.000.000 de claveles en un año. La técnica permite también multiplicar especies de plantas con reproducción lenta o dificultosa (como las orquídeas), o acelerar la producción de plantas bianuales.
TÉCNICAS BIOTECNOLÓGICAS PARA LA ELABORACIÓN DE CULTIVOS IN VITRO
La micropropagación o propagación clonal, es una de las aplicaciones más generalizadas del cultivo in vitro,A partir de un fragmento (explante) de una planta madre, se obtiene una descendencia uniforme, con plantas genéticamente idénticas, denominadas clones. El explante más usado para los procesos de propagación in vitro son las yemas vegetativas de las plantas. Los frascos que contienen las plantas se ubican en estanterías con luz artificial dentro de la cámara de crecimiento, donde se fija la temperatura en valores que oscilan entre los 21 y 23°C,además de Controlar la cantidad de horas de luz. Por su parte, el medio de cultivo se compone de una mezcla de sales minerales, vitaminas reguladores de crecimiento,azúcar, agua y agar. La composición del medio depende de la especie vegetal y de la etapa del proceso de micropropagación.
Con finalidad puramente descriptiva se puede clasificar los principales factores no biológicos que afectaran al desarrollo del cultivo in vitro , incluyendo:
• Ambiente químico
• Composición del medio de cultivo
• pH
• Ambiente físico
• temperatura
• luz y fotoperíodo
• humedad
Dentro del proceso de micropropagación diferenciamos varias fases o etapas:
• 0: Selección y Preparación de la planta madre
• 1: Desinfección de las yemas de la planta y/o desinfección de semillas
• 2: introducción del material seleccionado in vitro
• 3: Multiplicación de brotes
• 4: Enraizamiento
• 5: Aclimatación
Esta secuencia de etapas abarca el ciclo completo de la multiplicación de plantas in vitro ; puede ser aplicada a diferentes especies vegetales, en cada caso se podrán incluir simplificaciones o cambios de acuerdo a las características de las plantas, pero en términos generales son comunes al proceso de propagación in vitro.
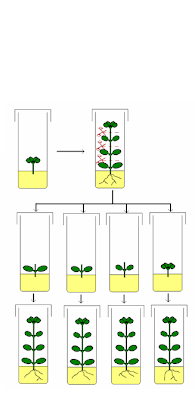 Figura 1. La micropropagación vegetal. A partir de una planta madre se obtienen numerosos explantos que, sujetos a condiciones y medios de cultivo adecuados, darán lugar a nuevas plantas iguales a la planta original, permitiendo su multiplicación.
Figura 1. La micropropagación vegetal. A partir de una planta madre se obtienen numerosos explantos que, sujetos a condiciones y medios de cultivo adecuados, darán lugar a nuevas plantas iguales a la planta original, permitiendo su multiplicación. FASE 0:
PREPARACIÓN DE LA PLANTA MADRE
Para poder establecer el cultivo en condiciones de asepsia, se deben obtener explantes con un nivel nutricional y un grado de desarrollo adecuado. Para obtener estos explantes es recomendable mantener a las plantas madre, es decir la planta donadora de yemas, durante un período de tiempo que puede oscilar entre unas semanas o varios meses en un invernadero bajo condiciones controladas. En ese ambiente se cultiva la planta en condiciones sanitarias óptimas y con un control de la nutrición y riego adecuados para permitir un crecimiento vigoroso y libre de enfermedades.
FASE 1:
DESINFECCIÓN DEL MATERIAL VEGETAL
Una vez elegida la planta madre, se extraerán los fragmentos a partir de los cuales se obtendrán los explantes. Los explantes pueden ser yemas, trozos de hojas, porciones de raíces, semillas, etc. Antes de extraer los explantes se hará una desinfección de los fragmentos de planta madre para eliminar los contaminantes externos. Los contaminantes más comunes son los hongos y las bacterias que habitan en forma natural en el ambiente. Una vez desinfectado el material vegetal, se debe mantener en condiciones de asepsia.
A efectos de obtener las condiciones de asepsia, se trabajará en cabinas de flujo laminar para extraer los explantes a partir del material vegetal. Estos explantes se introducirán en un tubo de cultivo conteniendo medio de iniciación para poder controlar la sanidad y la viabilidad, luego de realizar la desinfección del material con hipoclorito de sodio (agua clorada comercial), pura o diluída durante un período de 5a 15 minutos,seguido por 3 a 4 enjuagues en agua esterilizada.
FASE 2:
INTRODUCCIÓN DEL MATERIAL IN VITRO
Luego de la desinfección superficial, las semillas o las yemas dependiendo del material seleccionado, se ponen en medio de cultivo estéril. En un período de una semana o quince días, comienza el proceso de germinación o regeneración de nuevos tejidos vegetales, iniciando el ciclo de cultivo in vitro.
FASE 3:
MULTIPLICACIÓN DE LOS BROTES
Durante esta fase se espera que los explantes que sobrevivieron la FASE 1 y 2 originen brotes (de procedencia axilar o adventicia) con varias hojas. En la base de cada hoja hay una yema que se desarrollará luego de ser puesta en contacto con el medio de cultivo. Periódicamente estos nuevos brotes se deben subcultivar en un nuevo medio mediante divisiones y resiembras en tubos de cultivo u otros recipientes adecuados. Estas operaciones se realizan en la cámara de flujo laminar o en un lugar aislado que nos permita mantener las condiciones de asepsia. De esta forma aumenta el número de plantas en cada repique o división de las plantas.
El número de plantas que se obtiene dependerá de la especie vegetal y de las condiciones del medio de cultivo. El número de plantas que se obtiene por la vía de la micropropagación permite alcanzar incrementos exponenciales, considerando que todos los factores que afectan el crecimiento hayan sido optimizados.
FASE 4:
ELECCIÓN DE UN MEDIO DE ENRAIZAMIENTO DE LOS EXPLANTOS
Para enraizar los explantes se utilizan principalmente plantines individuales de un tamaño aproximado de 2 centímetros. Los brotes obtenidos durante la fase de multiplicación se transfieren a un medio libre de reguladores de crecimiento o que solo contenga hormonas del tipo auxinas. Algunas especies de plantas no necesitan pasar por esta etapa y emiten sus raíces en el mismo medio de cultivo donde desarrollan yemas nuevas, por lo tanto el proceso de multiplicación y enraizamiento transcurren en forma simultánea.
FASE 5:
ACLIMATACIÓN DE LOS EXPLANTOS ENRAIZADOS
Los explantes recién enraizados son muy sensibles a los cambios ambientales, de manera que el éxito o el fracaso de todo el proceso depende de la aclimatación. En esta etapa las plantas sufrirán cambios de diferente tipo que permitirán la adaptación de las mismas a vivir en condiciones naturales. En el momento en que se extraen los explantes o plantines enraizados de los frascos, están poco adaptados a crecer en un invernáculo, ya que estos explantes han enraizado y crecido en ambientes con una humedad relativa muy elevada y generalmente tienen estomas (estructuras responsables de regular la transpiración y pérdida de agua en la planta) que no son completamente funcionales frente a descensos de la humedad relativa, y por lo tanto demasiado lentos para evitar la desecación del explante. Por otra parte, crecer en ambientes tan húmedos también suele implicar la falta de una cutícula con cera bien desarrollada, que representa la barrera física para evitar la perdida de agua a lo largo de toda la superficie de la planta.
La siguiente lista presenta una comparación de las características de una planta en condiciones de laboratorio (in vitro) respecto a una planta en condiciones naturales invivo):
In vitro
• No realiza fotosíntesis
• Crecimiento en condiciones controladas
• Crecimiento en condiciones de asepsia
• Alta humedad relativa
• Estomas no funcionales
• Ausencia de pelos radiculares
• Ausencia de cera en la cutícula
In vivo
• Realiza fotosíntesis
• Crecimiento en condiciones no controladas
• Exposición a los patógenos y gérmenes del ambiente
• Humedad relativa variable
• Estomas funcionales
• Presencia de pelos radiculares
• Presencia de cera en la cutícula
Los plantines enraizados, deben ser aclimatados a las condiciones de humedad del invernadero disminuyendo progresivamente la humedad relativa e incrementando progresivamente la intensidad de luz. Estos plantines se plantarán en contenedores (almacigueras) cubiertos por un plástico, para mantener la humedad relativa elevada.
La elección de un sustrato con buenas características físicas, es clave para el éxito de esta etapa. Para el trasplante, elegimos un sustrato suelto, poroso, con mezcla de arena turba, cáscara de arroz quemado , para permitir un desarrollo y crecimiento de raíces muy rápido. Las mezclas son diferentes y muy variadas de acuerdo a la especie con la que estamos trabajando.
Luego de retirar cuidadosamente el agar de las raíces para evitar dañarlas, los plantines se enjuagan y se colocan en almacigueras con la mezcla de sustratos seleccionada y cubiertos con nylon. Todos los días se debe controlar el nivel de humedad en las almacigueras. Si es necesario, se aplica un riego con una pulverizadora manual, para mantener un ambiente húmedo a nivel del sustrato. A los 15 días del trasplante, se puede comenzar a levantar la cobertura de nylon en las horas de menor calor( temprano en la mañana o en la última hora de la tarde). Al comienzo las plantas se dejan media hora por día destapadas. A la semana siguiente se dejan destapadas durante una hora. Al mes del trasplante, se dejan tapadas durante la noche y si hay crecimiento de nuevas hojas, las plantas pueden permanecer destapadas. Las condiciones del cultivo in vitro , generan cambios en algunos aspectos anatómicos y fisiológicos de las plantas, por esta causa, durante la aclimatación, los cambios deben ser muy graduales, para minimizar el estrés y tener mayor tasa de sobrevivencia.
Desde el año 1991, el Laboratorio de Cultivo de Tejidos de la Unidad de Biotecnología de INIA, localizado en la Estación Experimental “Las Brujas”, ha estado trabajando en el ajuste de sistemas de multiplicación in vitro para diversas especies. El objetivo de estos trabajos de investigación es incorporar la micropropagación, como herramienta a los programas de mejora genética de INIA, en diferentes especies para acelerar y optimizar los procesos de evaluación a campo. Las especies vegetales estudiadas han sido: papa, boniato, ajo, frutilla, manzano, ciruelo, duraznero, peral, vid, frambuesa,zarzamora, arándanos, eucaliptos, marcela, especies aromáticas, especies forrajeras y otras.
A través de la propagación in vitro se ha podido disponer de material vegetal en diversas especies para su evaluación rápida. En especies como papa y frutilla, esta técnica está incorporada al esquema de selección y propagación del programa nacional de mejoramiento de hortalizas, todos los años se introducen clones de interés, obtenidos a partir de cruzamientos controlados. La multiplicación in vitro, permite la obtención de material con condiciones de sanidad superiores a los obtenidos por vía convencional. Las especies leñosas como los frutales de hoja caduca y especies forestales, en general necesitan medios de cultivo más complejos, la respuesta a las condiciones de cultivo resulta más lenta que en las especies herbáceas. A pesar de las dificultades que plantean, se ha desarrollado y adaptado mucha experiencia para varios materiales, principalmente en portainjertos de diversas especies de frutales.
Desde el año 2001 se están llevando a cabo diversos convenios de vinculación tecnológica con empresas e instituciones que agrupan a productores, obteniéndose resultados experimentales, a escala piloto de producción, muy importantes tanto para el avance de los proyectos de investigación como para el desarrollo de nuevas capacidades productivas, utilizando biotecnologías, en los sectores viveristas y semilleristas. A principios del año 2004 se estableció el primer sistema de franquicia para utilizar a escala comercial un protocolo de propagación in vitro de plantas de arándanos, como forma de apoyar la transferencia del paquete tecnológico ajustado por INIA hacia los laboratorios comerciales uruguayos. Con este mecanismo se ha buscado armonizar la demanda de plantas por parte de los productores interesados en este nuevo rubro y el interés de laboratorios comerciales y viveristas por ampliar los productos con calidad verificable que son ofrecidos a través de sus procesos de multiplicación de plantas.
PASOS NECESARIOS PARA GENERAR PLANTAS A PARTIR DE EXPLANTOS AISLADOS
Entre las ventajas del cultivo in vitro de material vegetal, se pueden incluir los tiempos más cortos, y la posibilidad de ocupar un espacio mucho más pequeño que si se desea propagar material en tierra.
Elementos necesarios para el cultivo de tejidos vegetales
Para llevar adelante este trabajo, se necesitan equipamientos que generen las condiciones necesarias de esterilidad, como los flujos laminares, que son estaciones de trabajo que hacen circular aire filtrado y estéril, protegiendo así
que se desea trabajar. Además, se necesita un soporte para el explanto, que puede ser sólido o líquido, y que está conformado por algún agente gelificante inerte (agar, gelrite, etc.), macro y micronutrientes esenciales para la supervivencia de la planta, nutrientes (hidratos de carbono, vitaminas), agentes reguladores del crecimiento y hormonas vegetales que ayudarán a obtener una planta o un órgano en particular, a partir del explanto elegido. Algunos de los elementos mencionados pueden ser reemplazados por mezclas poco definidas en su composición (jugo de tomate, agua de coco, etc.), que pueden dar buenos resultados y generalmente resultan más económicas. La acidez de los medios de cultivo para plantas suele variar entre pH=5 y 6,5. Luego se regulan las condiciones de temperatura y de fotoperíodo (relación de horas luz y horas oscuridad).
Según sea el balance hormonal y otras condiciones de cultivo, se puede propiciar la regeneración de distintos órganos o formaciones vegetales. Por ej., si el balance de citoquininas/auxinas (ver Tabla 1) es mayor que 1, se favorece la generación de brotes; si es menor que 1, la generación de raíces; y si es igual a 1, la formación de callos.
Tabla 1. Composición de medios de cultivo para células vegetales

CULTIVOS DE CELULAS VEGETALES
 El término genérico “cultivo de tejidos vegetales” involucra a diferentes técnicas de cultivo de material vegetal diverso, incluyendo a los protoplastos (células desprovistas de su pared celular), células, tejidos, órganos y plantas completas. Mediante éstas y otras técnicas de cultivo, es posible obtener plantas libres de microbios en un medio nutritivo aséptico (estéril) en condiciones ambientales controladas. También se lo conoce como “cultivo in vitro de plantas” por realizarse en recipientes de vidrio (hoy también de otros materiales).
El término genérico “cultivo de tejidos vegetales” involucra a diferentes técnicas de cultivo de material vegetal diverso, incluyendo a los protoplastos (células desprovistas de su pared celular), células, tejidos, órganos y plantas completas. Mediante éstas y otras técnicas de cultivo, es posible obtener plantas libres de microbios en un medio nutritivo aséptico (estéril) en condiciones ambientales controladas. También se lo conoce como “cultivo in vitro de plantas” por realizarse en recipientes de vidrio (hoy también de otros materiales).Las primeras experiencias relacionadas con el cultivo de tejidos vegetales se remontan a 1902, pero recién en 1922 se logró el primer experimento exitoso: la germinación in vitro de semillas de orquídeas. Luego de la germinación, las plántulas obtenidas se transfirieron a un medio de cultivo en condiciones asépticas, y así se mantuvieron protegidas del ataque de patógenos (hongos, virus y bacterias).
Hoy esta técnica tiene numerosas aplicaciones:
• Propagación masiva de plantas, especialmente para especies de difícil propagación por otros métodos, o en vías de extinción
• Clonación de individuos de características agronómicas muy deseables durante todo el año
• Obtención de plantas libres de virus
• Producción de semillas sintéticas
• Conservación de germoplasma (conjunto de individuos que representan lavariabilidad genética de una población vegetal)
• Obtención de metabolitos secundarios
• Producción de nuevos híbridos
• Mejora genética de plantas (incluyendo obtención de plantas transgénicas)
• Germinación de semillas.
• Producción de haploides.
• Estudios fisiológicos diversos.

Las bases biológicas del cultivo de tejidos: la totipotencialidad celular
La reproducción asexual de plantas por cultivo de tejidos es posible gracias a que, en general, varias células de un individuo vegetal poseen la capacidad necesaria para permitir el crecimiento y el desarrollo de un nuevo individuo completo, sin que medie ningún tipo de fusión de células sexuales o gametas. Esta capacidad se denomina totipotencialidad celular, y es característica de un grupo de células vegetales conocidas como células meristemáticas, presentes en los distintos órganos de la planta. La potencialidad de una célula diferenciada (una célula de conducción, epidérmica, etc.) para
generar tejidos nuevos y eventualmente un organismo completo, disminuye con el grado de diferenciación alcanzado por esa célula, pero puede revertirse parcial o completamente según las condiciones de cultivo a las que se la someta. Las células vegetales crecidas en condiciones asépticas sobre medios de cultivo adicionados con hormonas vegetales, pueden dividirse dando dos tipos de respuesta:
• una desdiferenciación celular acompañada de crecimiento tumoral, que da lugar a una masa de células indiferenciadas denominada callo, la cual bajo las condiciones adecuadas es capaz de generar órganos o embriones somáticos (llamados así porque son estructuras similares a un embrión, pero que no se originaron por unión de gametas),
• una respuesta morfogenética por la cual se forman directamente órganos (organogénesis) o embriones (embriones somáticos).
La primera respuesta se conoce como organogénesis o embriogénesis indirecta (mediada por un estado de callo) mientras que la segunda respuesta se considera organogénesis o embriogénesis directa.
El cultivo in vitro consiste en tomar una porción de una planta (a la que se denominará explanto, como por ej. el ápice, una hoja o segmento de ella, segmento de tallo, meristema, embrión, nudo, semilla, antera, etc.) y colocarla en un medio nutritivo estéril (usualmente gelificado, semisólido) donde se regenerarán una o muchas plantas.
La formulación del medio cambia según se quiera obtener un tejido desdiferenciado (callo), crecer yemas y raíces, u obtener embriones somáticos para producir semillas artificiales.
El éxito en la propagación de una planta dependerá de la posibilidad de expresión de la potencialidad celular total, es decir, que algunas células recuperen su condición meristemática. A tal fin, debe inducirse primero la desdiferenciación y luego la rediferenciación celular. Un proceso de este tipo sucede durante la formación de las raíces adventicias en el enraizamiento de estacas, la formación de yemas adventicias, o cuando se busca la propagación de begonias, violeta africana o peperonias mediante porciones de hojas. Uno de los factores más importantes a tener en cuenta para lograr la respuesta morfogenética deseada es la composición del medio de cultivo.
No existen dudas que en todo intento de propagación vegetal, ya sea in vitro o in vivo, el carácter del proceso de diferenciación depende del genoma de la especie, y que está regulado por el balance hormonal propio y por el estado fisiológico del órgano, tejido o célula puesta en cultivo. Sin embargo, también se sabe que ese balance puede ser modificado por el agregado de compuestos que imiten la acción de las hormonas vegetales. Estos compuestos se denominan reguladores del crecimiento, y se emplean en los medios de cultivo para conseguir la micropropagación de una planta.
La totipotencialidad celular es clave en el desarrollo de plantas genéticamente modificadas o transgénicas. Una vez realizada la transformación, ya sea por Agrobacterium o por el método de biobalística, el paso siguiente es el cultivo in vitro, con el fin de obtener, a partir del explanto inicial transformado, plántulas que lleven el transgén en todas sus células.
domingo, 23 de mayo de 2010
INTRODUCCION

La mejora genética de los productos agrícolas, lo que ahora llamamos la "biotecnología", no es nada nuevo. De hecho, es posible que sea una de las actividades más antiguas del hombre. Durante miles de años, las comunidades humanas se volvieron sedentarias y comenzaron a cultivar plantas y labrar la tierra, y en todo ese tiempo los humanos modificaron las características genéticas de los cultivos y de los animales que criaban. Las plantas fueron modificadas para mejorar su rendimiento, aumentar el sabor y alargar la campaña de cultivo.
Cada uno de los 15 tipos de plantas comestibles que constituyen el 90 % del alimento y la energía que se consume en el mundo han sido modificados extensamente y han pasado por hibridaciones, cruces y modificaciones a lo largo de los milenios por parte de innumerables generaciones de agricultores decididos a obtener sus cosechas de la manera más efectiva y eficiente posible.
Hoy, la biotecnología constituye una promesa para consumidores que buscan calidad, seguridad y sabor en sus alimentos preferidos; para los agricultores que buscan nuevos métodos para incrementar la productividad y la renta de sus explotaciones; y para quienes, desde el gobierno o instituciones privadas, tratan de terminar con el hambre en el mundo, asegurar la calidad del medio ambiente, preservar la biodiversidad y promover la sanidad y la seguridad de los alimentos.
RESUMEN

Al contrario de la manera tradicional de modificar las plantas que incluía el cruce incontrolado de cientos o miles de genes, la biotecnología vegetal permite la transferencia selectiva de un gen o unos pocos genes deseables. Con su mayor precisión, esta técnica permite que los mejoradores puedan desarrollar variedades con caracteres específicos deseables y sin incorporar aquellos que no lo son.
Muchos de estos caracteres desarrollados en las nuevas variedades defienden a las plantas de insectos, enfermedades y malas hierbas que pueden devastar el cultivo. Otros incorporan mejoras de calidad, tales como frutas y legumbres más sabrosas; ventajas para su procesado (por ejemplo tomates con un contenido mayor de sólidos); y aumento del valor nutritivo (semillas oleaginosas que producen aceites con un contenido menor de grasas saturadas).
Estas mejoras en los cultivos pueden contribuir a producir una abundante y saludable oferta de alimentos y proteger nuestro medio ambiente para las futuras generaciones.
En la base de las nuevas biotecnologías desarrolladas están las técnicas de aislamiento de células, tejidos y órganos de plantas y el crecimiento de estos bajo condiciones controladas (in vitro). Existe un rango considerable de técnicas disponibles que varían ampliamente en sofisticación y en el tiempo necesario para producir resultados útiles.
El desarrollo más crucial para la biotecnología fue el descubrimiento de que una secuencia de DNA (gen) insertado en una bacteria induce la producción de la proteína adecuada. Esto amplió las posibilidades de la recombinación y la transferencia de genes, con implicaciones a largo plazo para la agricultura a través de la manipulación genética de microorganismos, plantas y animales.
ABSTRACT
Plant life has been an elementary part in the life of animals and humans; of these important nutrients are obtained that allow the survival of many living things that live on Earth. The optimization of resources and mejoramieno of them, has led man from time immemorial, has managed processes for improvement, plant products being used farmaveutico food and the most interest. Currently, plant biotechnology is one of the technological tools that allow me to transfer a wider range of genetic information of a precise and controlled manner.
Unlike the traditional way of modifying plants including the uncontrolled crossing of hundreds or thousands of genes, plant biotechnology allows selective transfer of a gene or a few desirable genes. With its increased accuracy, this technique enables breeders to develop varieties with specific characteristics desired and without incorporating those who are not.
Many of these characters in the new varieties developed defend plants from insects, diseases and weeds that can devastate the crop. Others incorporate quality improvements, such as fruits and vegetables more palatable; advantages for processing (eg tomatoes with a higher content of solids), and increased nutritional value (oilseeds that produce oils with lower saturated fat content).
These improvements in crops can help to produce an abundant and healthy food supply and protect our environment for future generations.
On the basis of new biotechnologies are developed techniques for isolating the cells, tissues and organs of plants and growing them under controlled conditions (in vitro). There is a considerable range of techniques available that vary widely in sophistication and time required to produce useful results.
The most crucial development for biotechnology was the discovery that a DNA sequence (gene) inserted into a bacterium induces the production of adequate protein. This broadened the possibilities for recombination and gene transfer with long-term implications for agriculture through genetic manipulation of microorganisms, plants and animals